2024年1月Cell期刊精华
来源:生物谷原创 2024-01-28 08:28
2024年1月份即将结束,1月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2024年1月份即将结束,1月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:重大进展!首次开发出测量体内细胞随时间变化的方法
doi:10.1016/j.cell.2023.11.032
尽管物理学家仍在争论时间是否真地像爱因斯坦所说的那样是一种幻觉,但生物学家却毫不怀疑时间对于理解作为动态系统的生命的重要意义。近年来,他们利用多种工具对复杂的生物系统有了越来越深入的了解,这些工具可以同时分析大量的细胞和分子数据,并探测驱动疾病的细胞回路。然而,这些对细胞行为和相互作用方式的深入研究只能提供复杂生物体内部发生情况的单独快照,而无法考虑时间维度,也无法揭示细胞事件的顺序。
如今,在一项新的研究中,以色列魏兹曼科学研究院的Ido Amit教授及其团队首次成功开发出一种方法,用于跟踪和测量体内单个细胞随时间发生的变化。这种方法被称为 Zman-seq,包括用不同的时间戳标记细胞,并跟踪它们在健康或病理组织中的变化。利用这种细胞时间机器,他们可以了解细胞的历史,以及每个细胞在组织中停留了多长时间,最终了解组织中发生的分子和细胞时间变化。相关研究结果发表在2024年1月4日的Cell期刊上,论文标题为“Time-resolved single-cell transcriptomics defines immune trajectories in glioblastoma”。
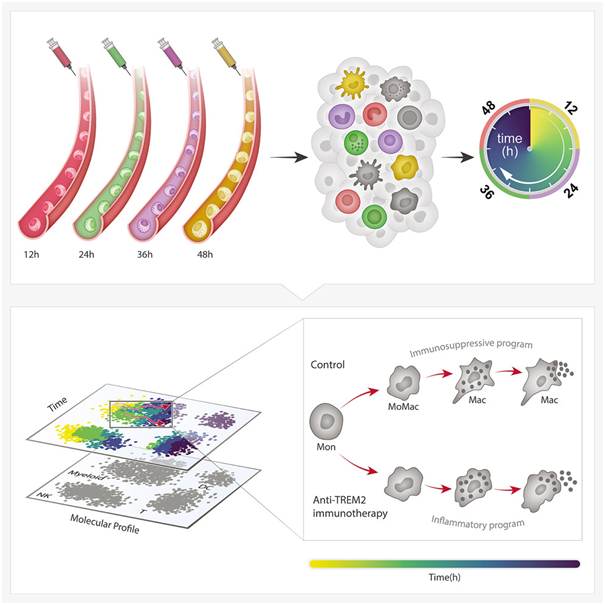
图片来自Cell, 2024, doi:10.1016/j.cell.2023.11.032
胶质母细胞瘤是免疫抑制作用最强的肿瘤类型之一。Kirschenbaum解释说,“要想了解如何战胜这种癌症,我们需要了解免疫细胞进入肿瘤后发生了什么,以及它们为什么会失去对抗肿瘤的能力并变得功能失调。理想情况下,我们希望每个细胞上都有一个小时钟,告诉我们它们何时进入肿瘤,以及指示它们丧失功能的信号和检查点何时被激活。这种回到未来的时间机器被认为是不可能开发出来的。”
当Kirschenbaum决定采取一种不可思议的方法时,突破出现了。“我们决定不尝试测量细胞在肿瘤组织内的时间,而是尝试在细胞还在血液中时---在它们进入肿瘤之前---对它们进行标记。通过在不同的时间点使用不同的荧光染料,我们后来就能准确地知道每个细胞何时进入组织,在那里呆了多长时间,这就揭示了组织内细胞发生的动态变化,比如,免疫细胞在肿瘤内功能失调的不同阶段是什么。”
作为这项新研究的一部分,Amit团队发现这种方法可以测量免疫细胞在不同组织---动物模型的大脑、肺部和消化系统---中的时间。利用Zman-seq,Kirschenbaum和他的同事们得以深入了解免疫系统在对抗胶质母细胞瘤时为何变得功能失调。
2.Cell:双特异性树突细胞-T 细胞结合剂可让癌症免疫疗法更有效
doi:10.1016/j.cell.2023.12.011
在一项新的研究中,来自以色列魏兹曼科学研究院的研究人员展示了一种新开发的抗体,它能将T细胞与树突细胞连接起来,从而对癌性肿瘤产生强大的免疫反应。这项研究为免疫疗法开辟了一条新途径:开发能将免疫系统中的多种细胞连接起来的治疗方法,以建立一支战胜癌症和其他疾病的强大战斗队伍。相关研究结果发表在2024年1月18日的Cell期刊上,论文标题为“Bispecific dendritic-T cell engager potentiates anti-tumor immunity”。
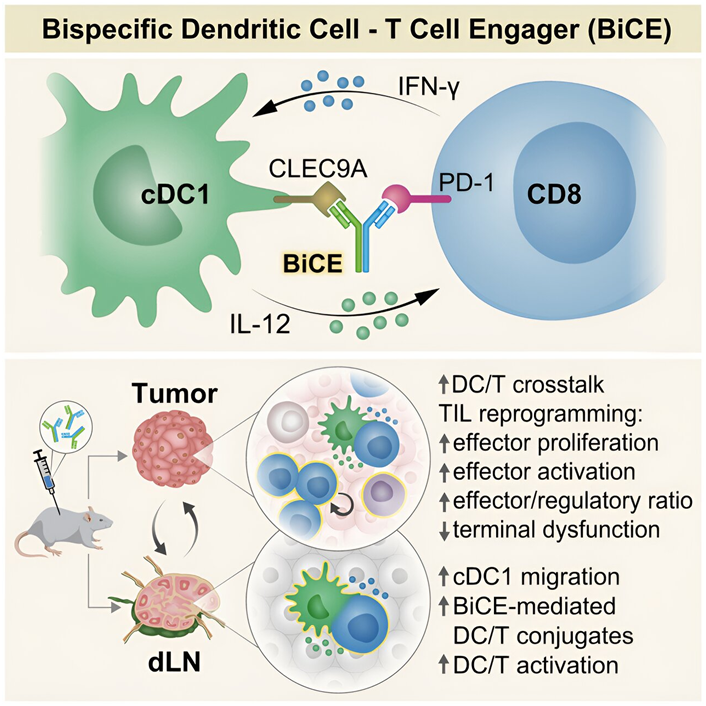
图片来自Cell, 2024, doi:10.1016/j.cell.2023.12.011
为了开发更有效的免疫疗法,魏兹曼科学研究院系统免疫学系Rony Dahan博士和Ido Amit教授实验室的研究人员首先提出了一个问题:为什么现有的治疗方法效果不佳?为了回答这个问题,他们从两种接受过 PD-1 抗体治疗的癌症小鼠模型中提取了 T 细胞样本。
Amit解释说,“利用单细胞DNA测序和大数据算法等先进技术,我们探究了近13万个T细胞,其中一些对治疗有反应,另一些则没有。令人惊讶的是,对治疗有反应的那组T细胞表达的基因与一个罕见的树突细胞群体相互作用。”
这些发现揭示了现有疗法的一个关键弱点:在大多数癌性肿瘤和目前接受 PD-1 抗体治疗的大多数患者中,很少存在这个相关的树突细胞群体。在这种情况下,这些树突细胞与它们激活的 T 细胞之间很少发生相互作用。
这种认识为设计一种名为 BiCE(Bispecific DC-T Cell Engager, 双特异性树突细胞-T 细胞结合剂)的新型抗体铺平了道路:其中的一个臂与T细胞结合,抑制PD-1受体,就像现有的治疗方法一样;另一个臂从这个罕见的树突细胞群体中招募树突细胞,这对激活T细胞至关重要。
这种抗体的开发由Dahan实验室的博士研究生Yuval Shapir Itai和Amit实验室的Oren Barboy领导。在研制出这种抗体后,这些作者对它的作用机制进行了研究。当他们用荧光标记物标记这种抗体和接受这种抗体治疗的皮肤癌小鼠的免疫细胞时,他们观察到了这种抗体是如何将 T 细胞与树突细胞物理连接起来,从而增加了癌细胞周围和邻近淋巴结中连接在一起的T 细胞和树突细胞的数量。
3.Cell:对11000多名非洲人后裔的研究发现了与青光眼有关的基因变异
doi:10.1016/j.cell.2023.12.006
作为一种遗传性疾病,青光眼是导致全球不可逆转性失明的主要原因,患病人数高达 4400 万。原发性开角型青光眼(primary open-angle glaucoma, POAG)是青光眼的最常见形式。虽然非洲裔人最常受到青光眼的严重影响,但很少有人研究过这一人群的遗传基础。
如今,在一项新的研究中,来自美国宾夕法尼亚大学等研究机构的研究人员揭示了导致POAG的遗传性基因变异。该研究基于对11275名非洲裔个体的分析。相关研究结果发表在2024年1月18日的Cell期刊上,论文标题为“A multi-cohort genome-wide association study in African ancestry individuals reveals risk loci for primary open-angle glaucoma”。
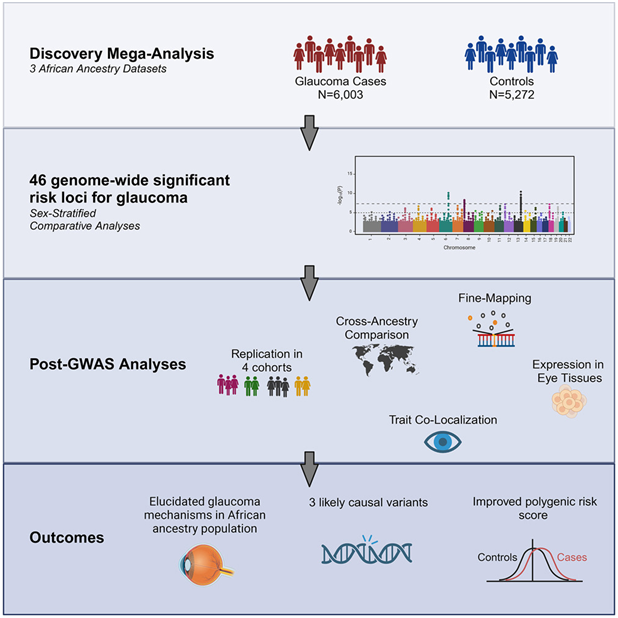
图片来自Cell, 2024, doi:10.1016/j.cell.2023.12.006
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院复杂疾病遗传学中心主任Joan O'Brien说,“与欧洲血统的人相比,非洲血统的人患青光眼的几率要高出五倍,因青光眼而导致视力下降或失明的几率要高出15倍。我们目前对这种致盲疾病的治疗还不够,如果我们能更清楚地了解这种遗传性神经变性的全部病理生理学,就能应用精准医疗。”
通过全基因组关联研究和其他形式的基因分析,这些作者发现了两个与青光眼形成有关的新型基因变异。这两个基因变异分别是与 DBF4P2 基因相关的 rs1666698 和与 ROCK1P1 基因相关的 rs34957764。
他们确定的第三个基因变异 rs11824032 与 ARHGEF12 密切相关。该基因变异以前在一项基因共定位分析中与杯盘比(cup-to-disk ratio)相关,其中杯盘比是青光眼严重程度的一种衡量指标。
4.Cell:从三维全肿瘤角度揭示胶质母细胞瘤的进化和异质性
doi:10.1016/j.cell.2023.12.013
胶质母细胞瘤是成人中致死率最高的原发性脑肿瘤。一项新的研究详细介绍了一个多学科研究团队开发出的一种首创的交互式三维空间方法,它能揭示新的治疗靶标,并为用户提供胶质母细胞瘤的全面三维图谱,为开发新的精准医疗策略提供参考。相关研究结果发表在2024年1月18日的Cell期刊上,论文标题为“Glioblastoma evolution and heterogeneity from a 3D whole-tumor perspective”。
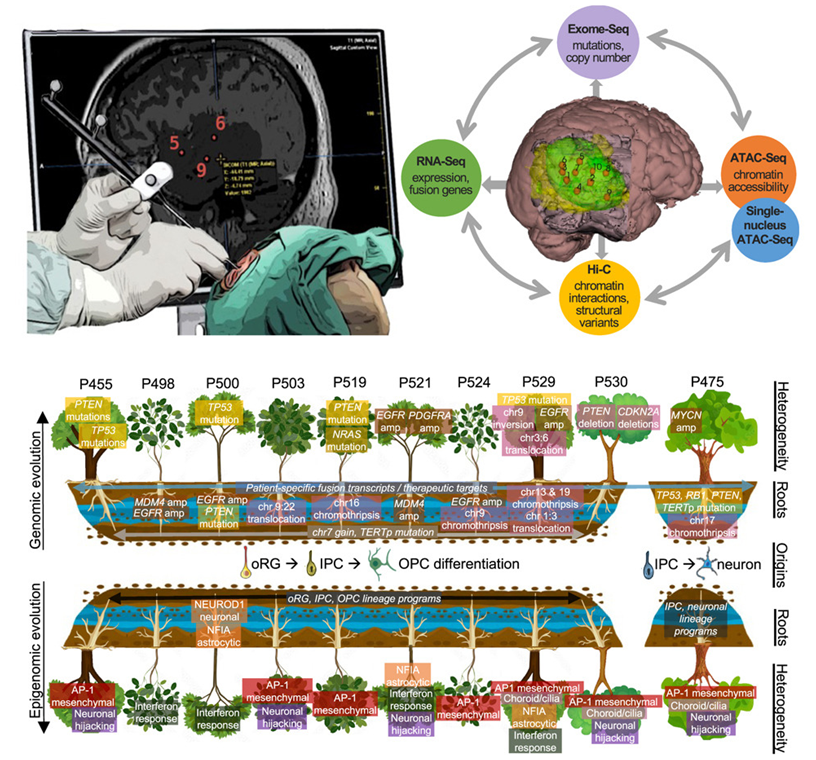
图片来自Cell, 2024, doi:10.1016/j.cell.2023.12.013
论文共同通讯作者、杜美国西北大学分子医学教授Feng Yue博士说,“这是首次在脑肿瘤或任何实体瘤中开展此类研究,你可以研究整个肿瘤的基因突变,而不是只关注肿瘤的某一部分。”
包括Yue在内的一个多学科研究团队开发出了一种新型三维神经导航平台,它可以帮助一次性识别患者胶质母细胞瘤多个区域中的肿瘤内特征和空间模式。这些作者随后将他们的平台用于 10 名新确诊和未经治疗的胶质母细胞瘤患者的肿瘤组织样本,并对100 多份突出了肿瘤多样性的样本进行空间绘图。他们然后将这些样本的坐标与患者大脑的核磁共振扫描结果整合在一起,绘制出患者整个肿瘤的360度交互式三维图谱。接着,Yue和他的合作者利用多种基因组学、表观基因组学和单细胞方法研究这些样本,揭示胶质母细胞瘤的微环境异质性和空间模式,使得他们能够确定这种肿瘤的最早起源和克隆进化。
此外,在他们的三维系统中,用户可以选择突出显示肿瘤中的哪些特征,包括基因组、表观基因组和微环境突变,这可以帮助科学们家更好地理解肿瘤可能用于产生治疗抵抗性的进化分子途径。
doi:10.1016/j.cell.2023.12.018
在一项新的研究中,来自英国牛津大学的研究人员发现了一种新的机制,通过这种机制,大脑可以产生强大而持久的记忆,从而驱动不明智的行为。相关研究结果发表在2024年1月18日的Cell期刊上,论文标题为“Coordinating brain-distributed network activities in memory resistant to extinction”。
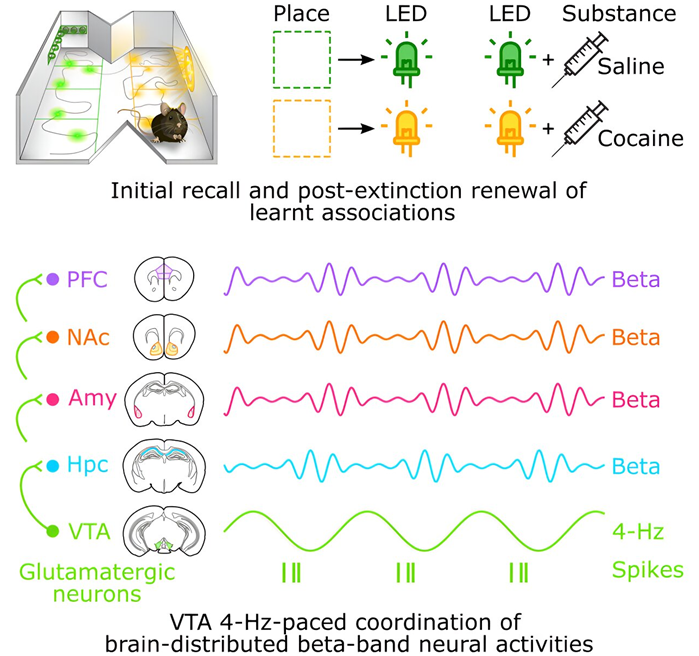
图片来自Cell, 2024, doi:10.1016/j.cell.2023.12.018
通过着重关注可卡因体验,这些作者展示了分布在大脑中的许多神经细胞的集体活动如何支撑这类记忆的持久性,从而为了解为何寻求毒品的行为会导致成瘾提供了新的见解。
这些作者认为,之所以某些不想要的记忆异常强烈,可能是因为这些记忆利用了多个大脑区域之间的大规模合作。他们选择将重点放在可卡因体验上,以模拟一种改变行为的显著体验,以及一种具有明显影响的体验。
通过监测神经细胞群体,他们观察到,不同大脑区域同时增加的活动预示着强大而持久的记忆的呈现。降低这种增强的活动可以让这些小鼠恢复更为适当的行为。
doi:10.1016/j.cell.2023.12.015
在一项新的临床前研究中,来自美国希望之城的研究人员发现人体内一种已知对过敏和其他免疫反应很重要的免疫细胞也能攻击癌症。此外,这种称为人类 2 型先天性淋巴细胞(type 2 innate lymphoid cell, ILC2)的细胞可以在体外扩增,并以更大的数量应用于癌症小鼠模型中,以压制肿瘤的防御并消灭恶性肿瘤细胞。相关研究结果于2024年1月10日在线发表在Cell期刊上,论文标题为“Therapeutic application of human type 2 innate lymphoid cells via induction of granzyme B-mediated tumor cell death”。
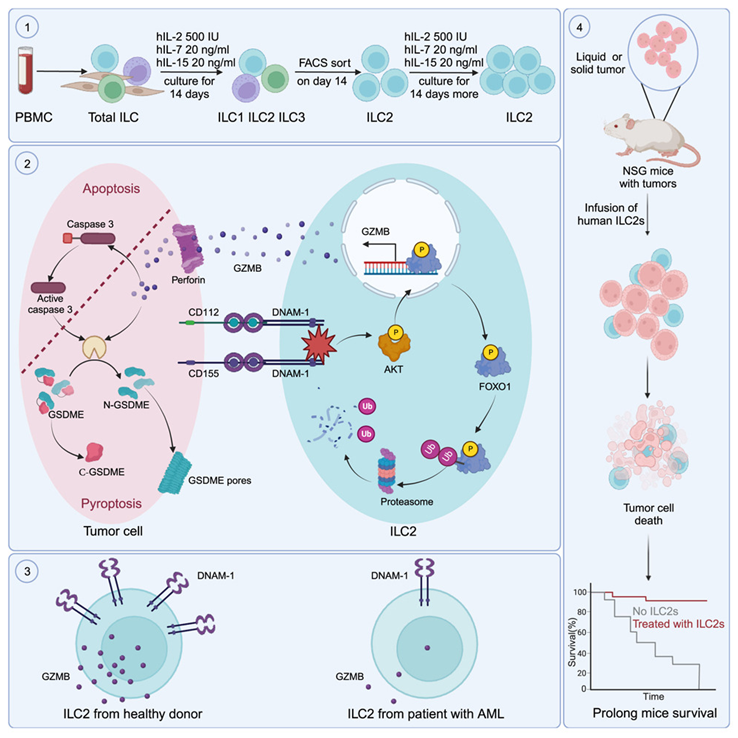
图片来自Cell, 2024, doi:10.1016/j.cell.2023.12.015
论文共同通讯作者、希望之城血液学与造血细胞移植系教授Jianhua Yu博士说,“我们发现人类ILC2细胞是能够直接杀死所有癌症类型(包括血癌和实体瘤)的细胞家族的新成员。在未来,这些细胞可以制造出来,冷冻保存,然后给患者使用。与CAR-T细胞等基于T细胞的疗法(因其特殊性而必须使用患者自身的细胞)不同,ILC2可能来自健康的捐献者,可作为一种异体的‘现成’产品,因而提供了一种独特的潜在治疗方法。”
在以前以小鼠细胞为重点的研究中,ILC2在癌症杀伤能力测试中并没有表现出一致的前景。然而,在希望之城的高度转化实验室中,这些作者优先对人体细胞进行了检测,发现人ILC2与小鼠ILC2的作用并不相同。
论文共同通讯作者、血液学与造血细胞移植系教授Michael Caligiuri博士说,“通常情况下,小鼠是预测人类免疫力的可靠模型,因此发现人类 ILC2 具有直接杀死癌症的功能,而小鼠的 ILC2 却不具有这种功能,这在该领域着实让人大吃一惊。从老鼠到人类中,有些东西进化得如此不同,这是值得注意的。”
7.Cell:利用新开发的CellHint将来自世界各地的单细胞数据统一起来
doi:10.1016/j.cell.2023.11.026
在一项新的研究中,来自英国韦尔科姆基金会桑格研究所、剑桥大学、EMBL 欧洲生物信息研究所(EMBL-EBI)等研究机构的研究人员开发了一款名为 CellHint 的工具,用于人类健康和疾病研究。CellHint利用机器学习来统一世界各地产生的单细胞数据,使更广泛的研究界能够访问这些数据,从而推动新发现。相关研究结果近期发表在Cell期刊上,论文标题为“Automatic cell-type harmonization and integration across Human Cell Atlas datasets”。
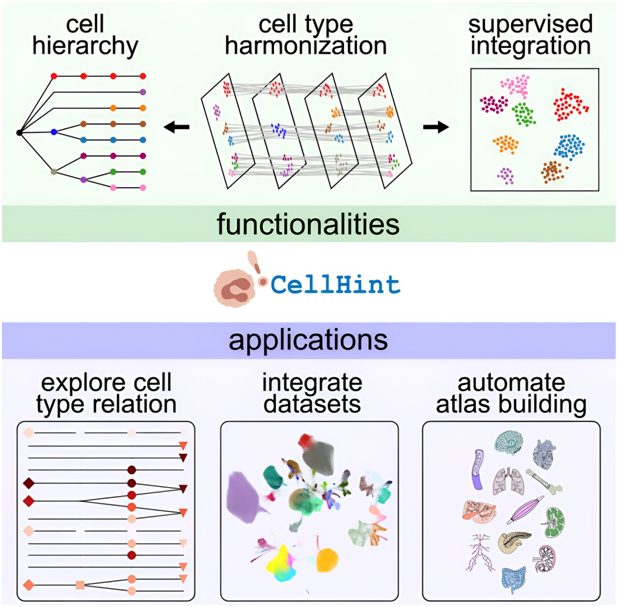
图片来自Cell, 2023, doi:10.1016/j.cell.2023.11.026
这些作者利用CellHint揭示了健康肺细胞状态与患病肺细胞状态之间尚未被充分探索的联系。他们研究了间质性肺病和慢性阻塞性肺病等八种疾病,并展示了这一工具可能带来的益处。他们还将CellHint应用于来自38个数据集的12个组织,提供了一个包含约370万个细胞的深度加工的跨组织数据库。
论文第一作者、韦尔科姆基金会桑格研究所的Chuan Xu博士说,“CellHint之所以能从其他工具中脱颖而出,是因为它充分利用了单个研究中往往不一致但却很有价值的细胞注释信息,实现了生物驱动的数据整合。我们很高兴有了CellHint,来自独立实验室的细胞可以被重新标注,科学家们可以利用由此产生的信息将每个细胞置于原始研究之外的不同背景中。我们希望这一工具能极大地促进分子和细胞数据及信息在不同实验室间的重复使用,从而推动生物学的新发现。”
doi:10.1016/j.cell.2023.12.012
在此之前,大脑类器官是通过诱导胚胎干细胞或多能性干细胞生长成代表大脑不同区域的结构,从而在实验室中培育出来的。他们使用特定的分子混合物,试图模拟大脑的自然发育---这种分子混合物的“配方”都需要大量的研究才能开发出来。
如今,在一项新的研究中,来自荷兰马克西马公主儿科肿瘤中心和胡布勒支研究所等研究机构的研究人员直接利用人类胎儿脑组织培育出了大脑类器官。相关研究结果于2024年1月8日在线发表在Cell期刊上,论文标题为“Human fetal brain self-organizes into long-term expanding organoids”。

图片来自Cell, 2024, doi:10.1016/j.cell.2023.12.012
在Delilah Hendriks 博士、Hans Clevers 博士和 Benedetta Artegiani 博士的领导下,这些作者吃惊地发现,使用小块胎儿脑组织而不是单个细胞对培育微型大脑至关重要。要培育出肠道等其他微型器官,科学家们通常会将原始组织分解成单个细胞。
不过,在使用小块胎儿脑组织时,这些作者发现这些小块胎儿脑组织可以自组装成大脑类器官。这些大脑类器官的大小与米粒差不多。它们具有复杂的三维结构,包含多种不同类型的脑细胞。重要的是,这些大脑类器官中含有许多所谓的外侧放射状胶质细胞(outer radial glia)---一种在人类和我们的进化祖先中发现的细胞类型。这凸显了这些大脑类器官与人类大脑的密切相似性以及在研究中的用途。
doi:10.1016/j.cell.2023.12.002
CD4结合位点(CD4bs)是HIV-1包膜(Env)上的一个保守表位,其能被保护性的广谱中和性抗体(bnAbs)靶向作用,HIV-1疫苗并不会诱发CD4bs bnAbs,其原因有很多,包括多糖会阻断CD4bs,携带免疫原的合适原始B细胞的扩张,以及功能性抗体突变的选择等。近日,一篇发表在国际杂志Cell上题为“Vaccine induction of CD4-mimicking HIV-1 broadly neutralizing antibody precursors in macaques”研究报告中,来自杜克大学医学院等机构的科学家们通过研究表示,成功研发HIV疫苗的途径依赖于关键的第一步,即激活特定免疫细胞来诱导广谱中和性抗体的产生。

科学家在开发人类HIV疫苗上取得突破性进展。图片来源:Cell (2024). DOI:10.1016/j.cell.2023.12.002
文章中,研究人员通过对猴子进行研究迈出了重要的一步,下一阶段他们将转向对人类进行试验;文章第一作者Kevin O. Saunders说道,这项研究证实了,在结构和遗传水平上,抗体与我们作为保护性HIV疫苗基础的人类抗体相似;如今我们的研究走在了正确的道路上,而从这里开始,我们只需要开始将疫苗的其它组分组合在一起进行相应的研究。
在早期研究工作中,研究人员从个体机体中分离出了自然产生的广谱中和性抗体,随后回溯到抗体和病毒所经历的改变,从而达到天然抗体及其在HIV包膜上的结合位点的原始起点。基于这些知识,研究人员设计出了一种特殊分子,其能诱发模拟天然抗体及其在HIV包膜上结合位点的抗体的产生。四年前研究者Saunders等人在Science杂志上发表文章指出,当猴子接种了这种工程化的免疫原后就会产生中和性抗体,但研究者并不确定是否这些抗体能像人类疫苗所需的广谱中和性抗体一样。
当前研究中,研究人员制造出了一种新型更有效的疫苗配方,并能将其注射到猴子体内,这次他们的目标就是确定是否在动物体内所产生的中和性抗体在结构和遗传上类似于人体所需的抗体。研究人员认为他们从2019年开始就已经走在了正确的研究道路上了,如今他们在原子水平取得了更多研究细节来证实他们的研究发现,而这或许是为开发有效的HIV疫苗迈出的重要一步。
10.Cell:新研究表明一种诱饵受体有望阻止东方马脑炎病毒感染
doi:10.1016/j.cell.2023.11.031
通过对东方马脑炎病毒(Eastern equine encephalitis virus, EEEV)如何与一种关键受体结合并进入细胞内部的原子级研究,来自美国华盛顿大学圣路易斯医学院的研究人员在一项新的研究中,发现了一种能保护小鼠免受这种潜在致命的脑部感染的诱饵分子。这一发现加深了人们对病毒蛋白与动物细胞受体之间复杂分子相互作用的理解,为开发针对EEEV感染的治疗和疫苗奠定了基础。相关研究结果于2024年1月3日在线发表在Cell期刊上,论文标题为“Structural and functional basis of VLDLR usage by Eastern equine encephalitis virus”。
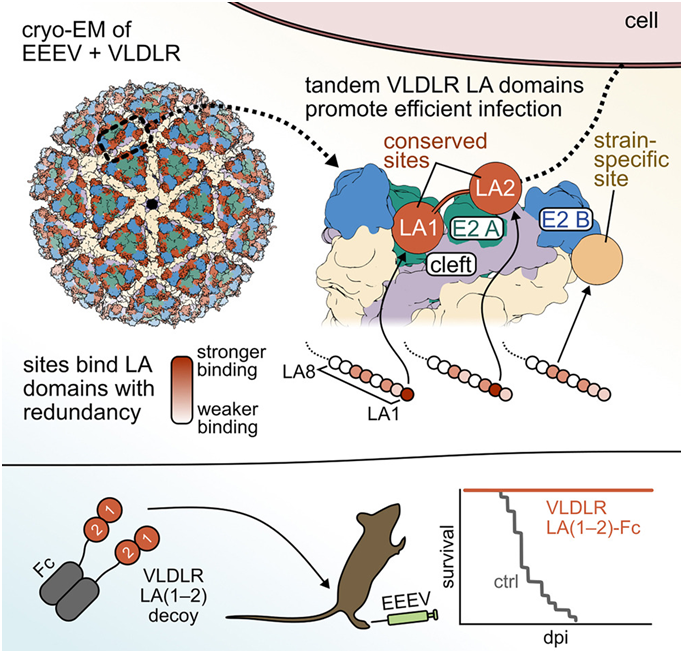
图片来自Cell, 2024, doi:10.1016/j.cell.2023.11.031
论文共同通讯作者、华盛顿大学医学博士Michael S. Diamond说,“了解病毒如何与它们感染的宿主细胞相互作用是预防和治疗病毒性疾病的关键部分。一旦你了解了这一点,你就有了开发疫苗和药物来阻止它的基础。在这项研究中,我们花了很长时间才理清与这种特定受体-病毒相互作用相关的复杂性,但一旦我们掌握了这些知识,我们就能设计出一种诱饵分子,结果证明这种分子能非常有效地中和EEEV,保护小鼠免受它的感染。”
作为寻找治疗或预防这种致命病毒方法的第一步,Diamond和论文共同通讯作者、华盛顿大学病理学与免疫学教授Daved H. Fremont博士着手研究EEEV如何附着到它的一种关键受体,即一种叫做极低密度脂蛋白受体(very low density lipoprotein receptor, VLDLR)的分子。这种受体分子存在于大脑和身体其他部位的细胞表面上。作为Fremont实验室和Diamond实验室的一名博士生,论文共同第一作者Lucas Adams利用冷冻电镜以原子级细节重建了EEEV与VLDLR的结合。
他们获得的结果出乎意料地复杂。VLDLR分子由八个重复的片段(称为结构域)组成,这些结构域像珠子一样串在一起。通常,病毒蛋白与它的受体以一种非常特殊的方式结合在一起。然而,就EEEV而言,病毒表面蛋白上的两三个不同位点能够附着到VLDLR分子的八个结构域中五个结构域的任何一个上。
Fremont说,“真正令人震惊的是,我们发现了多个结合位点,但每个结合位点的化学性质都非常相似,而且与其他与相关受体相互作用的病毒的结合位点的化学性质也很相似。这种化学性质非常适合病毒附着在细胞膜上的方式。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


